Spektakulär: Wissenschaftler haben reines Wasser in Metall verwandelt!
In einer neuen Forschungsarbeit haben Chemiker entdeckt, dass eine metallische Wasserlösung durch massive Elektronendotierung bei der Reaktion von Wasser mit Alkalimetallen hergestellt werden kann.

Reines Wasser ist ein nahezu perfekter Isolator. Ja, das Wasser in der Natur leitet Elektrizität aufgrund der Verunreinigungen, die sich in freie Ionen auflösen und den Fluss elektrischer Ströme ermöglichen. Reines Wasser wird erst bei einem extrem hohen Druck, der unsere derzeitigen Möglichkeiten übersteigt, "metallisch" - also elektronisch leitfähig -.
Die Forscher haben jedoch zum ersten Mal gezeigt, dass nicht nur hohe Drücke diesen Zustand in reinem Wasser hervorrufen können. Bringt man reines Wasser mit einem elektronentragenden Alkalimetall - in diesem Fall einer Legierung aus Natrium und Kalium - in Kontakt, können sich frei bewegliche geladene Teilchen hinzufügen und das Wasser metallisch machen.
Professor Jungwirth und seine Kollegen aus der Tschechischen Republik, den Vereinigten Staaten, Deutschland, Ägypten und Japan setzten einen Tropfen einer Natrium-Kalium-Legierung (NaK) einer kleinen Menge Wasserdampf aus, der an seiner Oberfläche zu kondensieren begann.
Die daraus resultierende Leitfähigkeit hält nur wenige Sekunden an, aber es ist ein bedeutender Schritt, diese Phase des Wassers zu verstehen, indem man sie direkt untersucht.
Unter ausreichend hohem Druck könnte theoretisch jedes Material leitfähig werden. Die Idee ist, dass sich die Bahnen der Außenelektronen überlappen, wenn man die Atome stark genug zusammendrückt, sodass sie sich bewegen können. Für Wasser beträgt dieser Druck etwa 48 Megabar, was etwa dem 48-Millionenfachen des atmosphärischen Drucks der Erde auf Meereshöhe entspricht.
Um grupo de cientistas de Química Orgânica e Bioquímica de vários países conseguiram transformar água pura em metal dentro de uma câmara a vácuo controlando as condições de pressão. pic.twitter.com/XPlxbJaJgk
— Davi Moura (@DaviMoura__) July 31, 2021
Obwohl in einer Laborumgebung höhere Drücke erzeugt wurden, wären solche Experimente für die Untersuchung von metallischem Wasser ungeeignet. Daher wandte sich ein Forscherteam um den organischen Chemiker Pavel Jungwirth von der Tschechischen Akademie der Wissenschaften den Alkalimetallen zu.
Diese Stoffe geben ihre Außenelektronen sehr leicht ab, sodass sie die elektronenverteilenden Eigenschaften von reinem Wasser mit hohem Druck auch ohne den hohen Druck hervorrufen können. Es gibt nur ein Problem: Alkalimetalle sind mit flüssigem Wasser sehr reaktionsfreudig, manchmal bis hin zur Explosion.

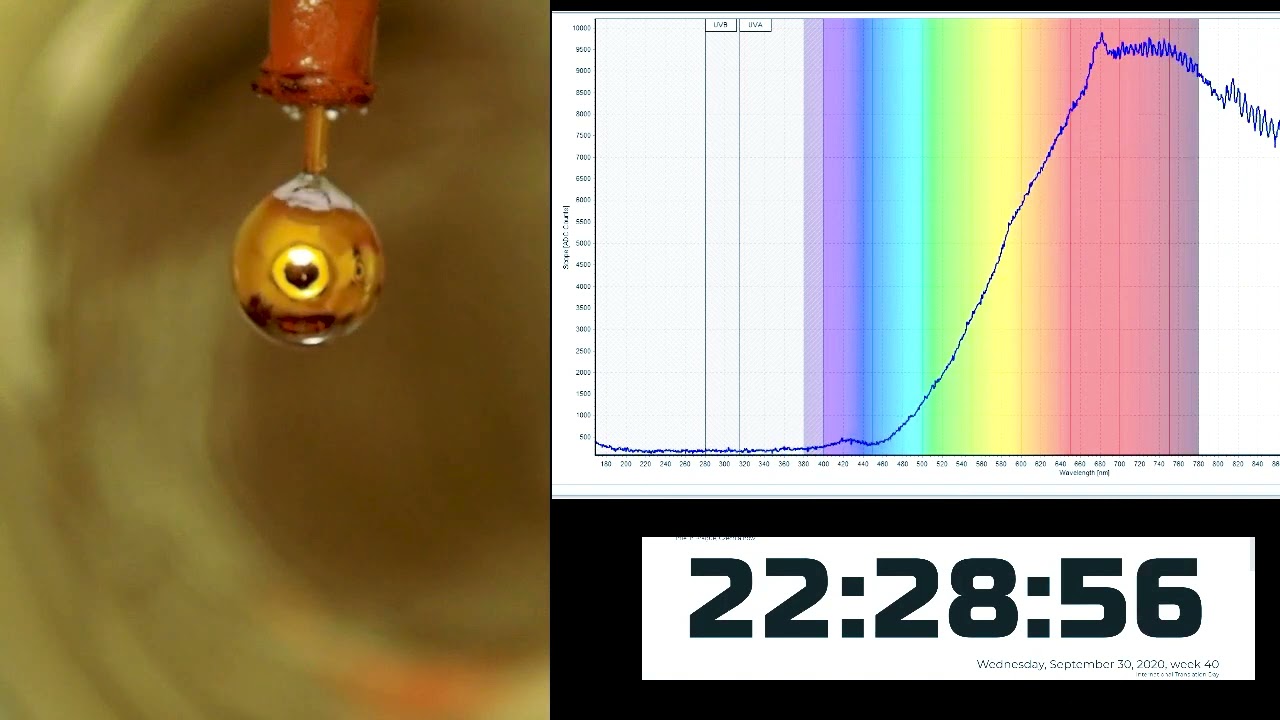
Das Forschungsteam hat einen wirklich coolen Weg gefunden, dieses Problem zu lösen. Was wäre, wenn man nicht Metall zu Wasser, sondern Wasser zu Metall hinzufügen würde? In einer Vakuumkammer extrudierte das Team zunächst einen kleinen Klecks Natrium-Kalium-Legierung, die bei Raumtemperatur flüssig ist, in eine Düse und fügte vorsichtig einen dünnen Film aus reinem Wasser durch Aufdampfen hinzu.
Durch den Kontakt zwischen Wasser und Metall fließen Elektronen und Metallkationen (positiv geladene Ionen) aus der Legierung ins Wasser. Dadurch wurde das Wasser nicht nur goldfarben, sondern auch leitfähig, genau wie es bei reinem Metallwasser unter hohem Druck der Fall sein sollte.
Dies wurde durch optische Reflexionsspektroskopie und Synchrotron-Röntgenphotoelektronenspektroskopie bestätigt. Die beiden Eigenschaften - das goldene Glühen und das leitende Band - belegten zwei unterschiedliche Frequenzbänder, sodass beide eindeutig identifiziert werden konnten.
Die Forschungsarbeiten ermöglichen nicht nur ein besseres Verständnis dieses Phasenübergangs hier auf der Erde, sondern könnten auch eine detaillierte Untersuchung der extremen Hochdruckbedingungen im Inneren großer Planeten ermöglichen.




